Chemischer Fotokalender 2024
Wissenschaft ist Magie, die funktioniert.
Kurt Vonnegut
Projektbeschreibung
Das Leistungsfach Chemie hat im Rahmen eines mehrstündigen Praktikums zahlreiche Experimente zum Thema Redoxreaktionen durchgeführt. Bei der Durchführung der Versuche standen die Aufnahmen gelungener Fotos für einen chemischen Monatskalender im Vordergrund.
Bei Redoxreaktionen wird immer ein Reaktionspartner oxidiert und ein anderer reduziert. Durch die Zugabe von sauren oder alkalischen Lösungen oder von Wasser, durch Wärme, Spülmittel oder auch einfach durch Luft, kann der Verlauf der Reaktion beeinflusst werden.
Viel Spaß beim Betrachten der Bilder!

Der Fotokalender 2024 im Überblick
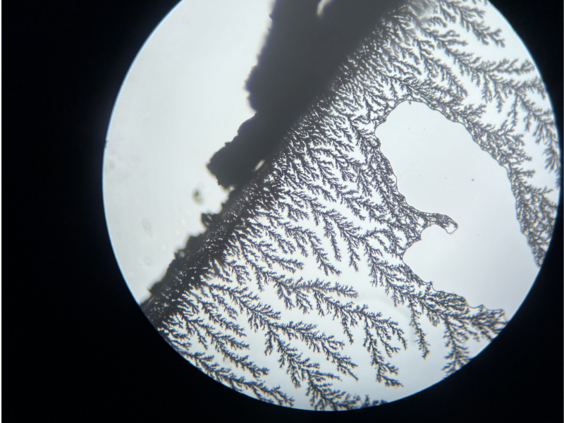









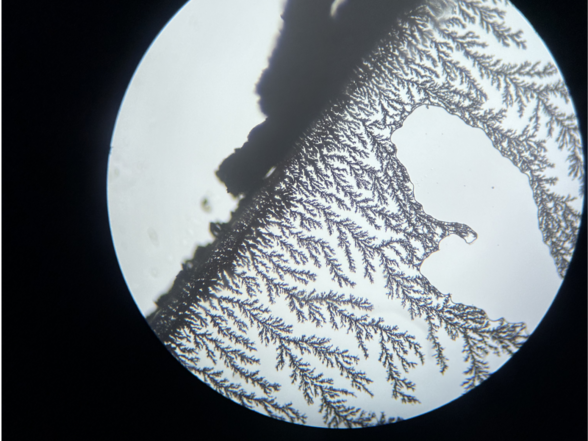
Januar 2024
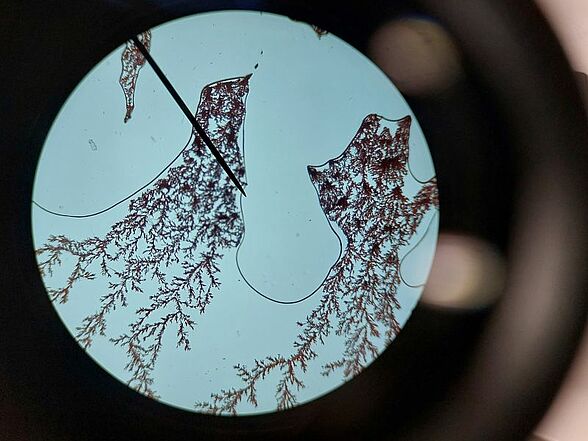
Kupferchlorid reagiert mit Zink zu Kupfer und Zinkchlorid. Dieses Foto wurde ausgewählt, weil es an eine Winterlandschaft erinnert.
Versuchsdurchführung
Ein Tropfen Kufperchloridlösung wird auf einen Objektträger getropft, dann wird ein Deckgläschen vorsichtig darauf gelegt. Seitlich wird ein Zink-Plättchen an das Deckgläschen geschoben, so dass es Kontakt zur Flüssigkeit und dem Deckgläschen hat. Nach kurzer Wartezeit ist das Wachsen von Kupferbäumchen bereits ohne Mikroskop erkennbar.
Es gibt auch Aufnahmen, bei denen die Kupferbäume kupferfarben zu sehen sind.
Februar 2024
Die Glucose im Gummibärchen reagiert mit alkalischer Kaliumpermanganatlösung. Dabei wird die Glucose zu Gluconsäure oxidiert und die Permanganat-Ionen (violett) werden zu Manganat-Ionen (grün) reduziert.
Versuchsdurchführung
In eine Petrischale vermischt man Kaliumpermanganat-Lösung mit verdünnter Natronlauge und rührt kurz um. Dann wird ein Gummibärchen in die Mitte platziert. Die Gummibärchenfarbe löst sich zusätzlich auf und so werden, vor allem in verdünnten Lösungen die Farbeffekte eindrucksvoller.


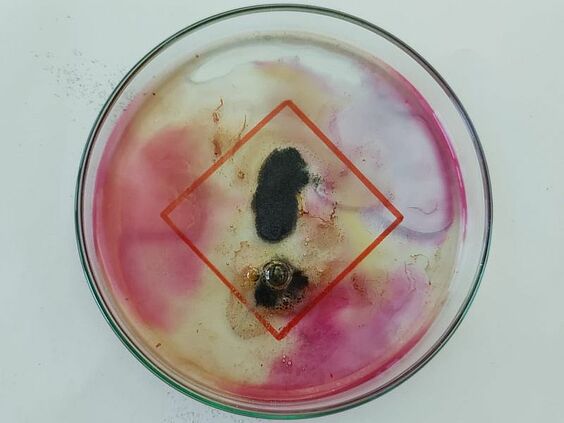
März 2024
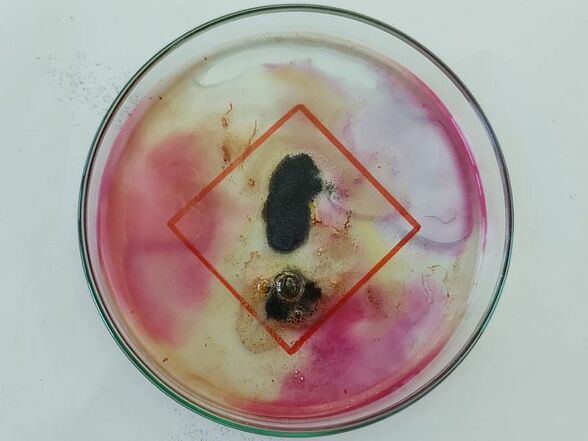
Das Foto stellt eines der Gefahrenpiktogramme dar, mit der die Aufbewahrungsbehälter von Salzsäure beschriftet sind. Dazu wurde die rote Raute auf ein Blatt Papier gemalt und als Hintergrund unter die Petrischale geschoben. Magnesiumpulver wurde in der Form eines Ausrufezeichens in die verdünnte Salzsäure-Lösung gegeben. Auf dem Foto ist die Wasserstoffentwicklung durch die Blasen erkennbar. Zusätzlich verändert sich der pH-Wert im Verlauf der Reaktion, dies wird durch die Farbänderung des Universalindikators deutlich.
Ziel des Versuchs
Magnesium reagiert mit verdünnter Salzsäure zu Wasserstoff und gelöstem Magnesiumchlorid. Die Schülerinnen und Schüler sollten das unterschiedliche Verhalten von Magnesiumband und Magnesiumpulver in verdünnter Salzsäure vergleichen.

April 2024
Die Schutzhülle wird mit dem Werkzeug eingeritzt. Die Platine wird für ca. 20 Minuten in eine angesäuerte Wassertoffperoxid-Lösung getaucht (eventuell stärker ansäuern, falls sich keine Kupfer-Ionen bilden). Das Experiment zeigt die Reaktion vor dem Ansäuern. Das Foto wurde ausgewählt, weil die Blasenbildung in Kombination mit der Schutzfolie und dem schimmernden Kupfer den Schüler*innen besser gefiel als die anschließende trübe Reaktionsmischung. Durch das Wasserstoffperoxid wird das freigelegte Kupfer zu Kupfer-Ionen oxidiert.

Mai 2024
Permanganat-Ionen (violett) können - je nach pH-Wert - zu Manganat-Ionen (grün), Braunstein (braun) oder Mangan-Ionen (fast farblos) reduziert werden. Sulfit-Ionen werden dabei oxidiert.
Versuchsdurchführung
In alle Schalendrittel gibt man Kaliumpermangantlösung.
- In Schalendrittel 1 zusätzlich mit Natriumsulfitlösung.
- In Schalendrittel 2 zusätzlich mit Natronlauge und 2 mL Natriumsulfitlösung.
- In Schalendrittel 3 zusätzlich mit Salzsäure und mit Natriumsulfitlösung.
Bemerkung: Beim ausgewählten Foto wurde - im Gegensatz zum alternativen Bild - in das dritte Schalendrittel noch nichts zur Kaliumpermanganat-Lösung hinzugefügt.


Juni 2024
Aluminium ist sehr unedel und oxidiert in Anwesenheit von verdünnten Kupfer- bzw. Zinkchloridlösungen sowohl mit den Metall-Ionen als auch mit dem Wasser im Reaktionsgefäß. Daher kann man zusätzlich zum metallischen Belag auf der Aluminiumfolie auch eine Gasentwicklung beobachten.
Versuchsaufbau
Becherglas 1: Aluminiumfolie in Kupferchlorid-Lösung
Becherglas 2: Zinnfolie in Kupferchlorid-Lösung
Becherglas 3: Aluminiumfolie in Zinkchlorid-Lösung
Bemerkung
Das Ziel des Experiments war die Entdeckung, dass Chlorid-Ionen die Aluminiumoxidschicht auf der Aluminiumfolie zerstören. Aluminium reagiert erst nach der Zugabe von Natriumchlorid mit einer Kupfersulfat-Lösung. Zinnfolie und Zinkchlorid-Lösung waren für Vorversuche mit im Experimentierkasten. Dieses Foto wurde ausgewählt, weil der Gruppe die Bläschenbildung im linken und rechten Becherglas gefallen hat.

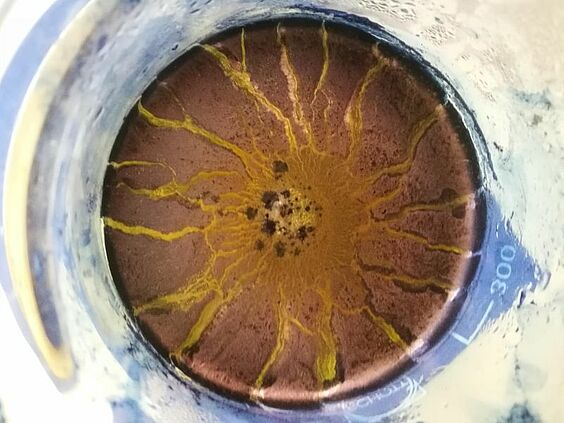
Juli 2024
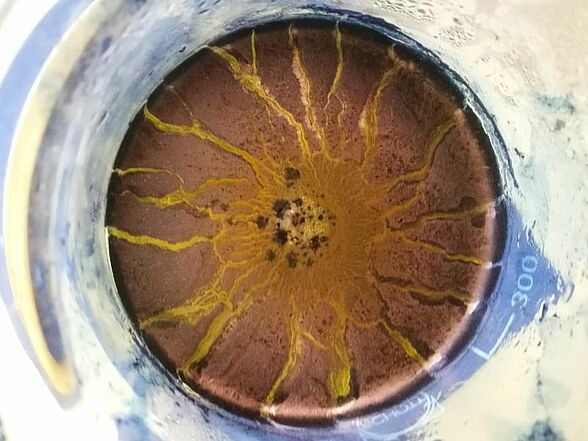
Beim Färben mit Indigo wirkt der Blick von oben in das Becherglas wie eine Sonne.
Versuchsdurchführung
Stark verdünnte Natronlauge wird in einem großen Becherglas mit Hilfe der Heizplatte auf 70° C erwärmt. In einem Reagenzglas werden 0,5 g Indigo in Ethanol gelöst und zu der erwärmten Lösung gegeben. Dem Farbbad wird unter ständigem Rühren Natriumdithionit hinzugefügt. Die Stoffprobe wird in das Farbbad gegeben und kurz zum Sieden erhitzt. Unter Rühren bleibt die Stoffprobe ca. 15 Minuten im Farbbad. Anschließend wird sie mit Wasser ausgespült und getrocknet.
Der Farbstoff Indigo
Indigo kommt in zahlreichen Pflanzen (Färberwaid, Indigopflanze) als Glucosid vor. Bereits ägyptische Mumientücher sind mit Indigo gefärbt. Eigentlich ist Indigo kein guter Farbstoff, da er weder waschecht noch abriebfest ist. Nur durch die „blue jeans“ wurde der Farbstoff wieder populär.

August 2024
Von dem Experiment "Indigo" wurden zwei Bilder ausgewählt, weil beide sehr gut sommerliche Motive darstellen. Der Blick von der Seite wirkt wie ein Weizenfeld mit Himmel.
Hintergrundinformationen
Zuerst muss der wasserunlösliche Indigofarbstoff reduziert werden, um ihn wasserlöslich zu machen. Dazu wird der Farbstoff im Reagenzglas mit Ethanol aufgeschlämmt und dann in die alkalische Lösung unter Rühren gegeben. Dann wird das erwärmte Färbebad mit Natriumdithionit versetzt. Der gelöste Farbstoff ist gelb, man nennt dies die Leuko-Form.
Ist der Farbstoff gelöst, beginnt man mit dem Verküpen. Der Stoff, der gefärbt werden soll, wird mit der Lösung verkocht, so dass der Farbstoff auf die Faser aufziehen kann. Danach erfolgt das „Verhängen“ an der Luft. Dabei wird der Farbstoff vom Sauerstoff aus der Luft oxidiert und er bekommt seine blaue Farbe wieder.


September 2024
Das Experiment darf nur in Anwesenheit und Unterstützung der Lehrkraft durchgeführt werden. Bei dem Experiment wird Kaliumpermanganat zu Braunstein reduziert. Braunstein katalysiert die Zersetzung von Wasserstoffperoxid, deswegen ist eine heftige Gasentwicklung zu beobachten. Das Gas Sauerstoff kann durch die Glimmspanprobe nachgewiesen werden.
Versuchsdurchführung
Zwei Reagenzgläser werden mit jeweils etwas verdünnter Kaliumpermangant-Lösung gefüllt.
Reagenzglas 1: Zugabe von 3%-iger Wasserstoffperoxid-Lösung und Durchführen der Glimmspanprobe
Reagenzglas 2: Zugabe von 30%-iger Wasserstoffperoxid-Lösung

Oktober 2024
Beim Experiment "Elefantenzahnpasta" gefiel der Gruppe die Dynamik des fliegenden Reaktionsgemischs besonders gut.
Versuchsdurchführung
In einem hohen Standzylinder wird etwas Spülmittel gegeben.
In Becherglas 1 wird eine Wasserstoffperoxid vorbereitet.
In Becherglas 2 wird Kaliumiodid in Wasser gelöst.
Die Inhalte der beiden Bechergläser werden zeitgleich in den Standzylinder mit dem Spülmittel gegossen.
Vereinfacht kann man sagen, dass Kaliumiodid die Zersetzung von Wasserstoffperoxid katalysiert. Das Spülmittel schäumt durch die Sauerstoff-Entwicklung die Reaktionsmischung auf.


November 2024
Wie im Septemberbild werden Kaliumpermanganatlösung und Wasserstoffperoxid miteinander vermischt. Im Gegensatz zur vorherigen Versuchsdurchführung ist die Kaliumpermangantlösung angesäuert. Es bilden sich anstatt Braunstein farblose Mangan-Ionen und es findet keine Sauerstoff-Entwicklung statt.
Die beiden Schüler wollten den Prozess der Entfärbung in einem Bild dokumentieren: Zugabe der farbigen Lösung, Abnahme der Farbintensität, farblose Lösung.
Versuchsdurchführung
3 Erlenmeyerkolben mit verdünnter Wasserstoffperoxid-Lösung etwa 2 cm hoch füllen und dann jeweils leicht angesäuerte verdünnte Kaliumpermangant-Lösung zutropfen.

Dezember 2024
Ziel des Experiments
Das Verhalten beim Entzünden von Schießbaumwolle und Baumwolle sollte verglichen werden.
Den Schüler*innen gefiel das Foto der brennenden Baumwolle besser als das Experiment mit der Schießbaumwolle. Das ausgewählte Foto zeigt daher ausschließlich brennende Baumwolle in Form unseres Schul-Logos. Mit dem Foto kann man aber vor allem auch einen brennenden Weihnachtsbaum assoziieren.
