Chemischer Fotokalender 2021
Komisch, alles chemisch!
Dr. Mai Thi Nguyen-Kim
Projektbeschreibung
Der Basiskurs Chemie hat im Dezember 2020 zahlreiche Experimente mit sauren und alkalischen Lösungen durchgeführt. Das Ziel der Praktika waren Bildaufnahmen zu chemischen Inhalten, die die Entwicklung des Säure-Base-Begriffs ansprechend visualisieren.

Fotokalender


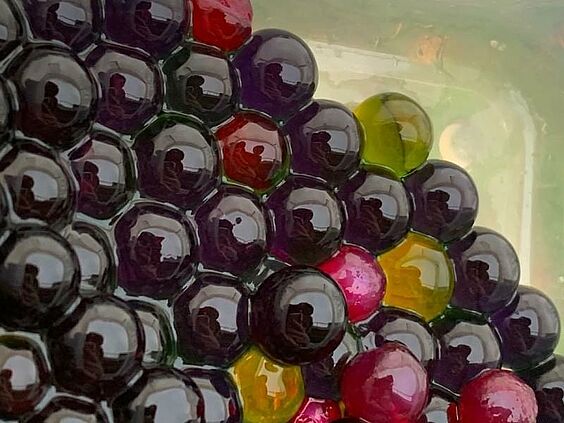








Chemische Grundlagen zur Entwicklung des Säure-Base-Begriffs
Altertum
Schon im Altertum war der Essig bekannt, weil er bei der alkoholischen Gärung von Früchten durch Oxidation des gebildeten Alkohols entstand. „Essig“ und „sauer“ sind Begriffe, die von den Griechen fast gleichbedeutend gebraucht wurden. Das griechische Wort für Essig ist „oxos“, für sauer „oxys“.
Auf dem Titelbild sieht man eine sauer schmeckende Zitronenscheibe, die mit Universalindikatorlösung versetzt wurde. Die rote Farbe zeigt an, dass es sich um eine saure Lösung handelt. Der Versuch wurde durchgeführt, um zu zeigen, dass Säuren auch im Alltag vertreten sind.
Das Januar-Bild zeigt ein angeritztes Stück Kernseife, das mit Universalindikatorlösung versetzt wurde. Die grün-blaue Farbe zeigt an, dass sie mit einer alkalischen Lösung überzogen ist. Kernseifen heißen auch Alkaliseifen. Im Arabischen bedeutet al-qalya „Pottasche“, dies ist ein Hinweis auf das Herstellungsverfahren von Alkaliseifen. Alkalische Lösungen wurden früher als Laugen bezeichnet, weswegen man auch heute noch teilweise den Begriff „Waschlauge“ verwendet.


17. Jahrhundert
Der irische Physiker und Chemiker R. Boyle (1627 – 1691) führte im 17. Jahrhundert eine erste allgemeine Definition für Säuren ein. Für ihn war die Farbänderung einiger Pflanzenfarbstoffe durch Säuren ein wesentliches Kennzeichen von Säuren. Andere Forscher legten besonderes Gewicht auf die Fähigkeit, die Wirkung von alkalischen Lösungen aufzuheben.
Das Februar-Bild zeigt in Wasser gelösten Rotkohlsaft (=Rotkohlindikator) in verschiedenen Reagenzgläsern. Zu diesen wurden verschieden konzentrierte saure und alkalische Lösungen gegeben, wodurch unterschiedliche Färbungen entstehen, da auch die zugehörigen pH-Werte der Flüssigkeiten verschieden sind.
Das März-Bild zeigt Wasserperlen, die über Nacht in Rotkohlsaft eingelegt waren. Rotkohlsaft hat ein Farbspektrum vom Rot für eine saure Lösung über Lila,Blau, Grün bis hin zu Gelb für eine stark alkalische Lösung. Die gelben Perlen hatten anschließend Kontakt mit Natronlauge, die roten Perlen mit Salzsäure. Nach einiger Zeit hatten alle Wasserperlen die gleiche rötlichblaue Farbe.
Später lernte man Stoffe kennen, die zwar keine alkalischen Lösungen bilden, aber mit Säuren zu Salzen reagieren. Etwa ab 1730 tritt in Frankreich für diese Stoffe die Bezeichnung Base auf, da sie als Basis für die Salzbildung aufgefasst werden.


18. Jahrhundert
A. L. Lavoisier (1743 – 1794), der Begründer der wissenschaftlichen Chemie, beobachtete, dass sich Nichtmetalle beim Verbrennen mit einem Bestandteil der Luft zu Stoffen verbinden, die sich in Wasser zu Säuren lösen. Den bei der Verbrennung gebundenen Luftbestandteil nannte er „gaz oxygène“, d. h. sauermachendes oder Säure bildendes Gas. Im Deutschen wurde dafür der Name Sauerstoff eingeführt. Nach Lavoisier enthielten alle Säuren Sauerstoff. Dieser Name wurde beibehalten, obwohl es inzwischen deutlich geworden ist, dass es Säuren auch ohne das Element Sauerstoff gibt.
Das April-Bild zeigt, dass bei der Reaktion von Metallen mit Sauerstoff in Anwesenheit von Wasser alkalische Lösungen entstehen. Natriumstücke schmelzen bei der Reaktion mit Wasser, da bei der Reaktion Wärme frei wird. Die Natriumstücke werden dadurch zu Natriumkugeln. Das entstehende Gas Wasserstoff treibt diese an, so dass sie sich auf der Wasseroberfläche hin und her bewegen. Bei der Reaktion mit Wasser entsteht eine alkalische Lösung, dies wird durch die Farbänderung des Indikators im Wasserschweif der Natriumstücke sichtbar.




Ende des 18. Jahrhunderts/Anfang des 19. Jahrhunderts
Zu dieser Zeit war die Zusammensetzung einiger Säuren (z. B. Milchsäure, Citronensäure, Blausäure, Essigsäure) bekannt. Fest stand damit, dass alle bisher bekannten Säuren Wasserstoffverbindungen, aber nicht unbedingt Sauerstoffverbindungen sind. Im Jahr 1838 hielt J. v. Liebig (1803 – 1873) in einem Zeitschriftenartikel fest, dass Säuren Wasserstoffverbindungen sind, in welchen Wasserstoffatome durch Metallatome ersetzt werden können. Hierdurch entstehen Salze der Säuren.
Die Bilderfolge zeigt die Reaktion von einem Teelöffel Backpulver mit etwas konzentriertem Haushaltsessig in einer Filmdose. Das entstehende Gas Kohlenstoffdioxid braucht mehr Platz, so dass sich der Deckel von der Filmdose löst und dann die Dose in die Luft katapultiert wird. Da die Reaktion sehr schnell abläuft, gab es bei den ersten Versuchen Schwierigkeiten beim Schließen der Filmdosen.
19. Jahrhundert
Das Mai-Bild zeigt die Neutralisation von Salzsäure mit Natronlauge. Das interessante Farbspiel entsteht durch die Zugabe von Universalindikatorlösung und Rotkohlsaft. Das entstehende Kochsalz löst sich in Wasser. Die Entstehung der Regenbogenfarben war unerwartet.
Auch beim Zusammenbringen einer Säure mit einem Metalloxid entsteht ein Salz, dabei bildet sich zudem Wasser. Das Salz, das bei der Reaktion eines Metalls oder Metalloxids mit einer Säure entsteht, liegt normalerweise gelöst vor.
S. Arrhenius (1859 – 1927) definierte im Jahr 1887 Säuren als Stoffe, die in Wasser Wasserstoffionen (H+-Ionen) abspalten; Basen als Stoffe, die in Wasser Hydroxidionen (OH- -Ionen) abspalten. Die Reaktion einer Säure mit einer Base wird als Neutralisation bezeichnet, deren wesentlicher Vorgang aus der Vereinigung von H+-Ionen und OH- -Ionen zu Wassermolekülen besteht.
Das Juni-Bild zeigt, wie Natronlauge, welche viele Hydroxid-Ionen enthält, ihre typische blaue Färbung durch die Zugabe von Universalindikator erhält. Salzsäure (rechts) färbt Universalindikator rot, aufgrund der vielen enthaltenen Oxonium-Ionen.
Ein Nachteil des Säure-Base-Konzepts von Arrhenius bildet die Beschränkung des Base-Begriffs auf Hydroxide. Viele Stoffe, zum Beispiel Ammoniak, bilden alkalische Lösungen, obwohl sie keine Hydroxide sind.


20. Jahrhundert
Der Däne J. N. Brønsted (1879 – 1947) hat den Säure-Base-Begriff 1923 neu gefasst. Etwa zur gleichen Zeit wurde diese Neufassung auch von dem englischen Chemiker T. Lowry (1874 – 1936) unabhängig von Brønsted vorgeschlagen. Teilchen, die bei einer Reaktion Protonen abgeben, nennt man Brønstedsäuren (Protonendonatoren). Teilchen, die bei einer Reaktion Protonen binden, nennt man Brønstedbasen (Protonenakzeptoren).
Einer konzentrierten Salzsäurelösung entweicht Chlorwasserstoff-Gas, einer konzentrierten Ammoniaklösung entweicht gasförmiger Ammoniak. Die beiden farblosen Gase reagieren unter Bildung von weißem, festen Ammoniumchlorid miteinander.
Das Juli-Bild zeigt, wie sich weißer Rauch bildet. Dabei reagieren Ammoniakmoleküle als Brønstedbase zu Ammonium-Ionen und Chlorwasserstoffmoleküle als Brønstedsäure zu Chlorid-Ionen.
Wenn ein Wassermolekül ein Proton aufnimmt, bilden sich Oxonium-Ionen; gibt es ein Proton ab, so bildet sich ein Hydroxid-Ion. Im August-Bild sieht man, dass diese Reaktion stattfindet, wenn man eine elektrische Spannung an eine wässrige Lösung anlegt. Auf der linken Seite war die Flüssigkeit mit Rotkohlsaft versetzt, auf der rechten Seite mit Universalindikatorlösung (durch die Verwendung von viel Indikator und von Petrischalen statt U-Rohren als Reaktionsgefäß wurden die Fotografien eindrucksvoller).


Bedeutung des pH-Werts
Der pH-Wert misst die Konzentration der Oxonium-Ionen. Bei einer Konzentration von 0,001 mol pro Liter ist der pH-Wert 3, denn die 1 steht an der dritten Stelle hinter dem Komma. Eine neutrale Lösung mit einem pH-Wert von 7 enthält 0,0000001 mol pro Liter. Das September-Bild zeigt Flüssigkeiten mit verschiedenen pH-Werten. Der pH-Wert wird hier durch die Farben des Indikators Bromthymolblau deutlich, vorausgesetzt man kennt die Bedeutung der Farben des jeweiligen Indikators.
Verwendete Chemikalien von links nach rechts: verdünnte Salzsäure, Essigsäure, Leitungswasser mit wenig Indikator, Leitungswasser mit viel Indikator, sehr verdünnte Natronlauge, verdünnte Natronlauge.

Vorsicht beim Umgang mit konzentrierten Säuren
Konzentrierte Schwefelsäure ist stark hygroskopisch, das bedeutet wasserentziehend. Das Oktober-Bild zeigt, dass konzentrierte Schwefelsäure in der Lage ist dem Naturstoff Zucker Wasser zu entziehen, zurück bleibt schwarzer Kohlenstoff. Dabei wird so viel Wärme frei, dass das Wasser teilweise verdampft. Der Wasserdampf schäumt den Kohlenstoff auf, deswegen entsteht ein sehr poröser schwarzer Feststoff.
Auch Baumwollstoffe und einige Kunststoffe werden von konzentrierter Salzsäure zerstört. Sicherheitsmaßnahmen wie Schutzbrille und Schutzhandschuhe sind daher notwendig beim Umgang mit konzentrierten, starken Säuren. Das November-Bild zeigt die Wirkung von etwa 2 ml konzentrierter Schwefelsäure auf einen Haushalts-Schwamm.




Eine unerwartete Base zum Schluss
Der gelbe Farbstoff von Textmarkern ist pH-Wert abhängig. Die gelbe Farbeverschwindet, wenn man die Farbe mit einer sauren Lösung betupft. Bei orangefarbenen und grünen Textmarkern ist der gelbe Farbstoff beigemischt, so dass diese Farben ebenfalls verblassen. Durch die Protonenaufnahme in das Molekül des gelben Farbstoffs bildet sich eine farblose Verbindung. Das Dezember-Bild zeigt, dass diese farblose Verbindung im UV-Licht leuchtet.